Teoría de Brönsted-Lowry
Según esta teoría, un ácido es una sustancia química que es capaz de ceder protones (H+) a otra sustancia química y una base es aquella sustancia química que es capaz de captar protones (H+) de otra sustancia química.
Según esta teoría una reacción ácido-base es un equilibrio que se puede expresar como:
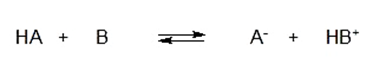
Donde HA se comporta como ácido, pues cede un protón H+ para quedarse como A–. Por otro lado, B se comporta como una base, pues capta un protón H+ para convertirse en HB+.
Algunas sustancias pueden comportarse como ácidos y como bases al mismo tiempo y se dice que son anfóteras. Esto depende del medio en que se encuentren o con quien reaccionen. Un ejemplo de este tipo de sustancias es el agua:
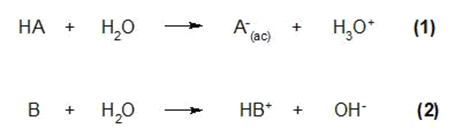
En la primera ecuación el agua capta un protón H+, comportándose como una base y convirtiéndose en H3O+. Mientras que en la ecuación (2), el agua cede un protón H+, comportándose como un ácido y convirtiéndose en OH–.

Comentarios
Publicar un comentario