Teoría de Arrhenius
Un ácido es aquella sustancia que cede protones (H+) en solución acuosa. Es decir, es una sustancia neutra, que cuando se disuelve en agua se disocia en sus iones según la siguiente reacción representativa:
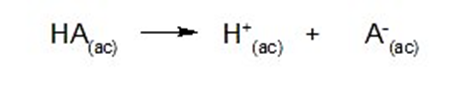
Por ejemplo: el ácido clorhídrico (HCl)
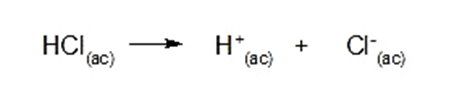
Una base es aquella sustancia que cede iones OH– en solución acuosa. Por ejemplo: el hidróxido de sodio (NaOH)
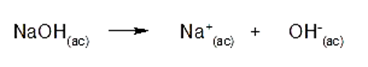
Esta teoría tiene sus limitaciones, pues según ella estos compuestos solo se definen en solución acuosa y no en otros medios. Además no explica compuestos como el amoníaco (NH3), que es una base, pero al no tener OH– en su composición, no cumple con la definición de base de Arrhenius.
Por todo esto, se necesitaba una nueva teoría que explicara mejor los conceptos de ácido y base. Así que más tarde Brönsted y Lowry desarrollaron una nueva teoría, que incluye los principios de Arrhenius pero no solo está pensada en solución acuosa, y por tanto, es mucho más amplia.

Comentarios
Publicar un comentario